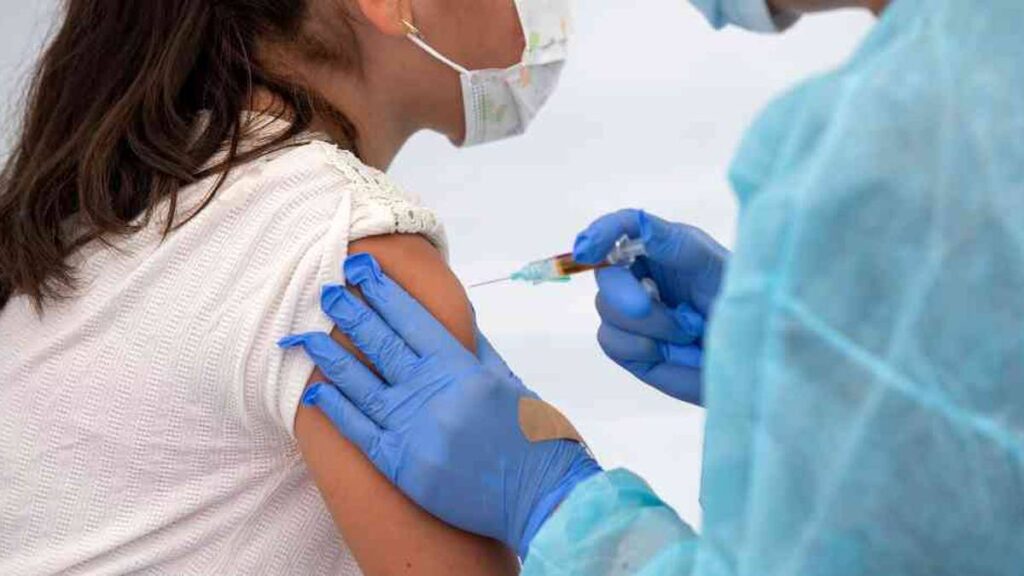
Pfizer y BioNTech anunciaron que se ha administrado su vacuna contra el coronavirus a las primeras participantes en un estudio global de fase 2/3 que evaluará la seguridad, tolerabilidad e inmunogenicidad de su fórmula en mujeres embarazadas sanas de 18 años o más.
«Estamos orgullosos de iniciar este estudio en mujeres embarazadas y de seguir reuniendo las pruebas de seguridad y eficacia para apoyar potencialmente el uso de la vacuna por parte de subpoblaciones importantes. Las mujeres embarazadas tienen un mayor riesgo de complicaciones y de desarrollar covid-19 grave, por lo que es fundamental que desarrollemos una vacuna que sea segura y eficaz para esta población», declaró el vicepresidente senior de Investigación y Desarrollo Clínico de Vacunas de Pfizer, William Gruber.
El ensayo de fase 2/3 está diseñado como un estudio aleatorizado, controlado con placebo y ciego a los observadores en aproximadamente 4.000 mujeres embarazadas sanas de 18 años o más vacunadas durante las semanas de gestación 24 a 34. El estudio evaluará la seguridad, tolerabilidad e inmunogenicidad de dos dosis de la vacuna o de placebo administradas con 21 días de diferencia. Cada mujer participará en el estudio durante aproximadamente siete a diez meses, dependiendo de su pertenencia al grupo que recibió la vacuna o el placebo.
El estudio evaluará la seguridad en los fetos de las mujeres embarazadas vacunadas y la transferencia a ellos de anticuerpos potencialmente protectores. Tras los partos, los bebés serán controlados hasta aproximadamente los seis meses de edad. Como se establece en el protocolo del estudio, después de que nazca el bebé de una participante, las participantes en el ensayo materno serán «desenmascaradas» y las que estaban en el grupo que recibió el placebo recibirán la vacuna.
Antes de llevar a cabo su ensayo clínico en mujeres embarazadas, Pfizer y BioNTech completaron una investigación de toxicidad requerido por las autoridades reguladoras. Estos estudios no mostraron ninguna evidencia de toxicidad para la fertilidad o la reproducción en los animales.
Pfizer y BioNTech esperan iniciar estudios adicionales en niños de entre cinco y once años «en los próximos meses», y en niños menores de cinco años «más adelante en 2021». La seguridad y la eficacia de la vacuna en personas de doce a quince años ya se están evaluando en un estudio global de fase 3 y está previsto presentar los datos pertinentes a las autoridades reguladoras «en el segundo trimestre de 2021». Las compañías también están planeando estudios para evaluar más la vacuna en personas con sistemas inmunológicos comprometidos.