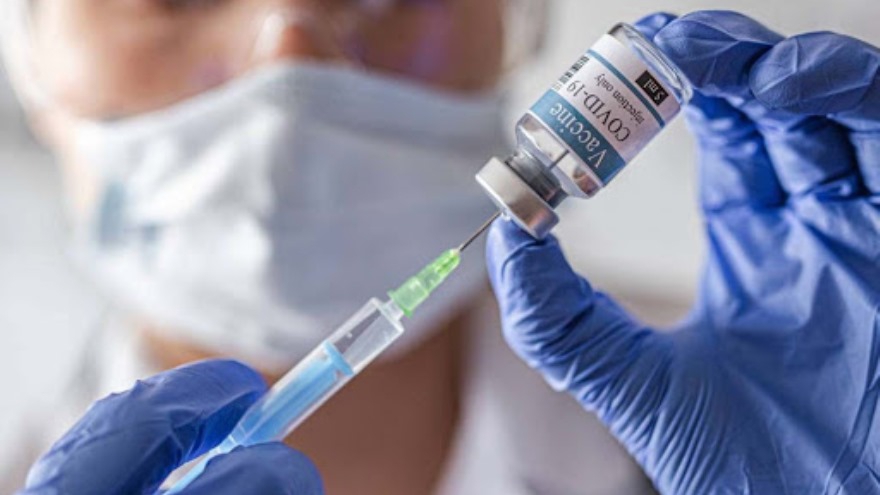
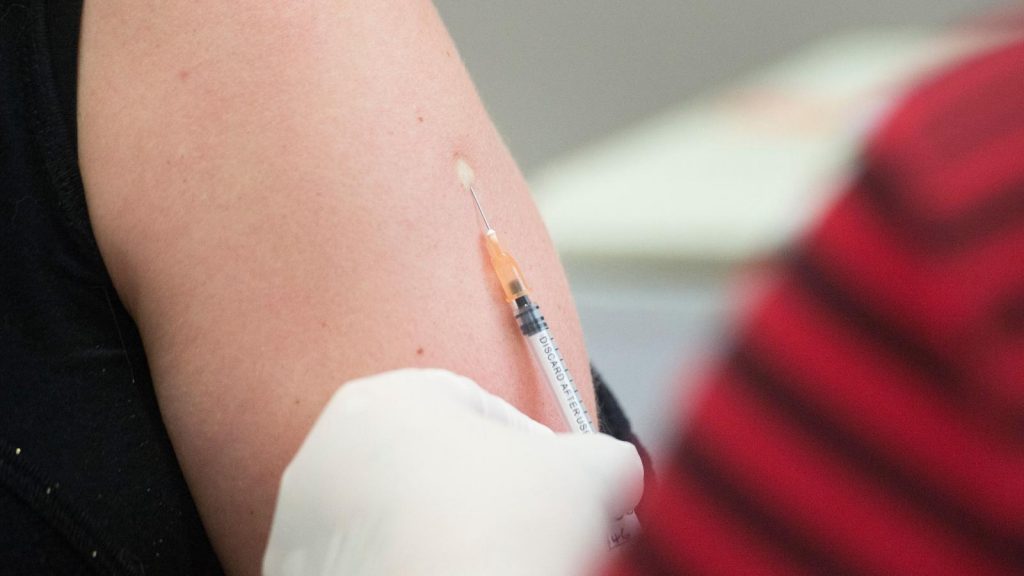
AstraZeneca cerró acuerdos para suministrar más de 200 millones de dosis de su vacuna candidata contra el coronavirus SARS-CoV-2 a…
AstraZeneca
El Gobierno de la Nación Argentina firmó un acuerdo con el laboratorio AstraZeneca para la entrega de 22 millones de…
La farmacéutica AstraZeneca reanudará el ensayo de su vacuna experimental contra el coronavirus en Estados Unidos, que ha estado en…
Un voluntario murió en Brasil mientras formaba parte del grupo de testeo de la vacuna de la Universidad de Oxford,…
El ensayo de la vacuna de AstraZeneca contra el coronavirus todavía está en pausa en Estados Unidos luego de que…
El gigante farmacéutico británico AstraZeneca afirmó el jueves que la vacuna contra el covid-19 que está desarrollando con la universidad…
Podía pasar y pasó. Una de las vacunas contra el coronavirus en la que millones de personas depositan sus esperanzas…
Hace algunos días, el presidente Alberto Fernández anunció que la Argentina será uno de los países encargados en la producción…
La vacuna AstraZeneca fue considerada la mejor candidata a nivel mundial y la vacuna más avanzada en términos de desarrollo,…
El laboratorio británico AstraZeneca, que va a producir la potencial vacuna contra el coronavirus con la Universidad de Oxford, anunció…