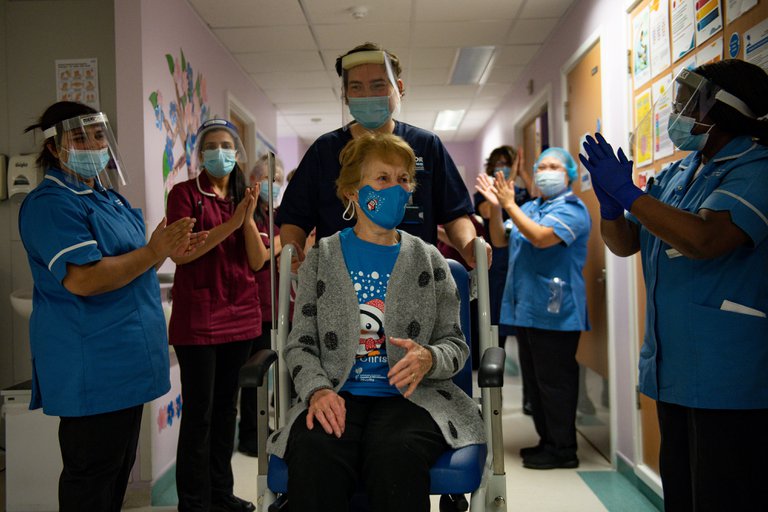
Margaret Keenan nunca creyó que en el tramo final de su vida su nombre recorrería el mundo. Tampoco que sería…
Pfizer
La compañía estadounidense Pfizer producirá la mitad de las dosis que había planeado originalmente para fines de 2020 después de…
Los desafíos en la cadena de suministro de Pfizer de las materias primas utilizadas en su vacuna de COVID-19 influyeron…
Reino Unido aprobó la vacuna contra el coronavirus de Pfizer y tiene previsto que esté disponible en todo el país…
Las empresas estadounidense Pfizer y la alemana BioNTech -que recibieron autorización de uso de emergencia de las vacunas contra el…
La vacuna contra el coronavirus desarrollada por Pfizer y BioNTech requiere una conservación a -70 °C (con un margen de…
En un hecho definido como «histórico», los reguladores británicos aprobaron la vacuna contra el coronavirus desarrollada por la empresa estadounidense…
El secretario de Sanidad de EEUU, Alex Azar, reiteró hoy que se podría comenzar a distribuir la vacuna contra el…
La vacuna contra el coronavirus creada por la farmacéutica estadounidense Pfizer y la alemana BioNTech puede comenzar a ser distribuida…
La farmacéutica estadounidense presentará este viernes el pedido de autorización para su vacuna contra el coronavirus ante la Administración de…