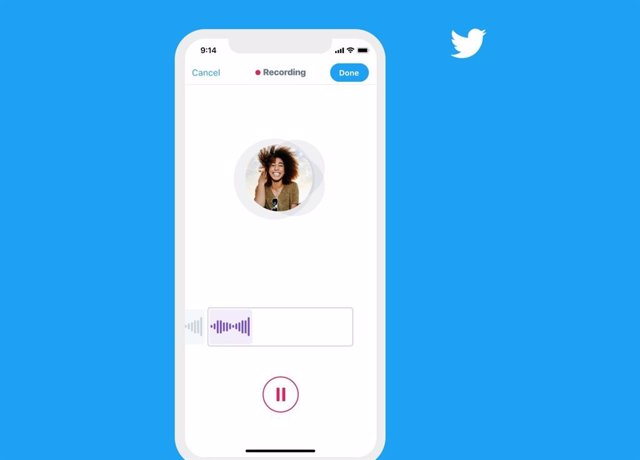
Se trata de un fármaco que ya está siendo probado en monos y sería efectivo para inmunizar a las personas…
pruebas
Los fiscales del juicio por la emergencia climática se opusieron al pedido de suspensión de juicio a prueba en donde…
Las primeras pruebas, testeos y demostraciones de la tecnología de 5G para conexiones de banda ancha móvil, la más avanzada…
El Plan Detectar sigue en Esquel durante el mes de febrero para testear COVID. El Centro de Encuentro está ubicado…
Twitter sigue adelante con la idea de implementar los mensajes de voz en su plataforma, tanto web como en la…
Las autoridades chinas han implementado un nuevo método para detectar el covid-19: el hisopado anal. Así lo reportan este 27…
La vacuna en investigación contra el coronavirus que desarrolla el laboratorio Janssen y que se encuentra en fase 3 se…
El ministro de Salud, Ginés González García, garantizó que las vacunas contra el coronavirus que se brinden en el país…
La farmacéutica estadounidense Johnson & Johnson confirmó anoche que detuvo la prueba clínica de su vacuna contra el Covid-19 debido…
La Universidad de Oxford comenzó a investigar la eficacia para su uso en pacientes con coronavirus del adalimumab, un tipo…