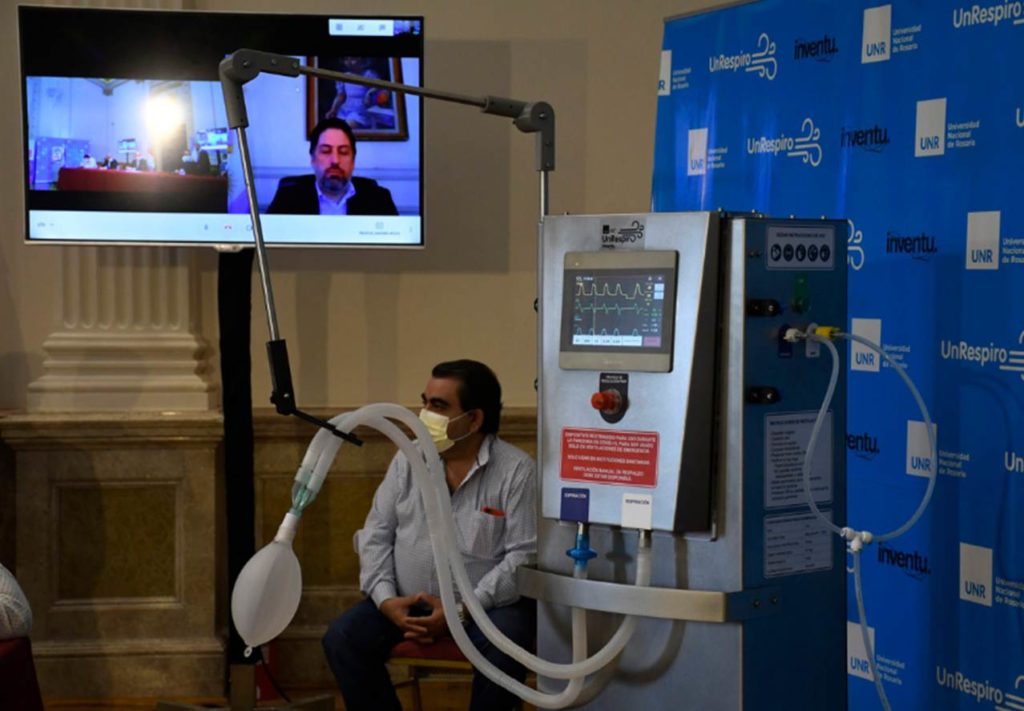
A sólo 20 días de haberlo anunciado, los investigadores que trabajaron en el desarrollo de un respirador artificial de bajo…
Buenas Noticias Coronavirus
La grave crisis que produjo el coronavirus puso a la mayor parte del mundo en cuarentena. Pero como todo lo…
El capitán del barco Mario R., Hernán García, afirmó que “fue un viaje tranquilo con buen tiempo. Tuvimos los problemas…
“La idea es romper la grieta, con una única programación”, aseguran desde el Gobierno, cuando hablan sobre la iniciativa de…
Integrantes de las comunidades, organizaciones sociales, académicos, institutos de idiomas y gobierno locales tradujeron a las lenguas originarias y sistematizaron…
Juan tiene 40 años y es profesor de Historia en la UBA. No viajó ni estuvo en contacto con enfermos,…
El Banco Central de la República Argentina (BCRA) emitió hoy una norma que otorga mayores incentivos a los bancos para…
Las autoridades de la República Popular China anunciaron el martes que la cantidad de pacientes «activos» es de solo 4.287…
El jefe de Gabinete, Santiago Cafiero, remarcó que la app es un «primer eslabón», donde los ciudadanos «podrán responder a…
La aerolínea Copa Airlines realizará tres vuelos humanitarios para trasladar a Argentina a un grupo de 300 personas, en medio…
En el marco de la cuarentena total que decretó el presidente Alberto Fernández para minimizar los contagios del coronavirus, el…