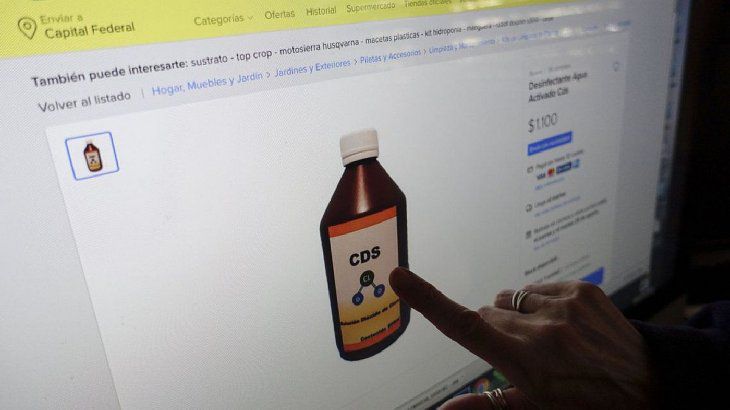
Fue creado por el laboratorio Hangzhou Immuno Biotech y se convirtió en el único aprobado por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica para la…
#Anmat
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) aprobó un nuevo tratamiento para pacientes adultos con un subtipo…
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) prohibió la comercialización de cuatro productos elaborados por la empresa…
La ANMAT prohibió el uso, la comercialización y la distribución en todo el territorio nacional de un barbijo, un suplemento y un…
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica a través de la Resolución 654/2021, publicada este jueves en el…
La ANMAT prohibió la elaboración, el fraccionamiento y la comercialización en todo el territorio nacional de un aceite de girasol, según se publicó…
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (Anmat) autorizó el pasado jueves a un laboratorio público de la…
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (Anmat) autorizó este jueves a un laboratorio público de la ciudad…
En su Boletín Oficial, la ANMAT indicó que el producto era vendido como «Libre de gluten» cuando no cuenta con…
Este miércoles, el Gobierno Nacional anunciará este mediodía que la vacuna rusa Sputnik podrá ser aplicada a mayores de 60…
Los productos no tiene datos veraces en su rotulado, por lo que se desconoce su origen y efectiva composición, destacó…
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (Anmat) autorizó este miércoles, bajo la modalidad de registro de emergencia,…
La directora de Evaluación y Registros de Medicamentos de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (Anmat), Agustina…
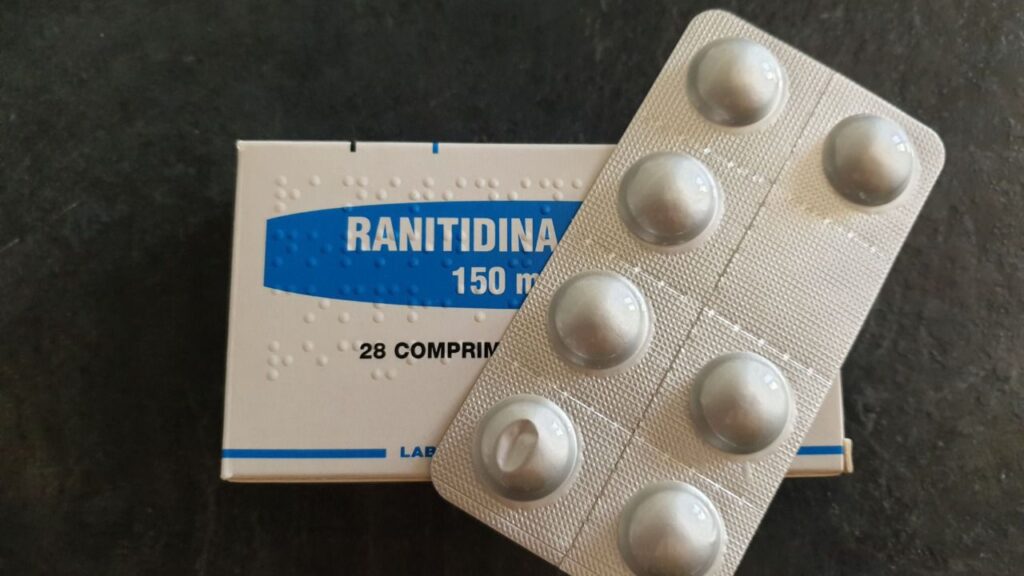
La medida rige de manera “preventiva” para el medicamento que se aplica en casos de gastritis, reflujos y otras afecciones…
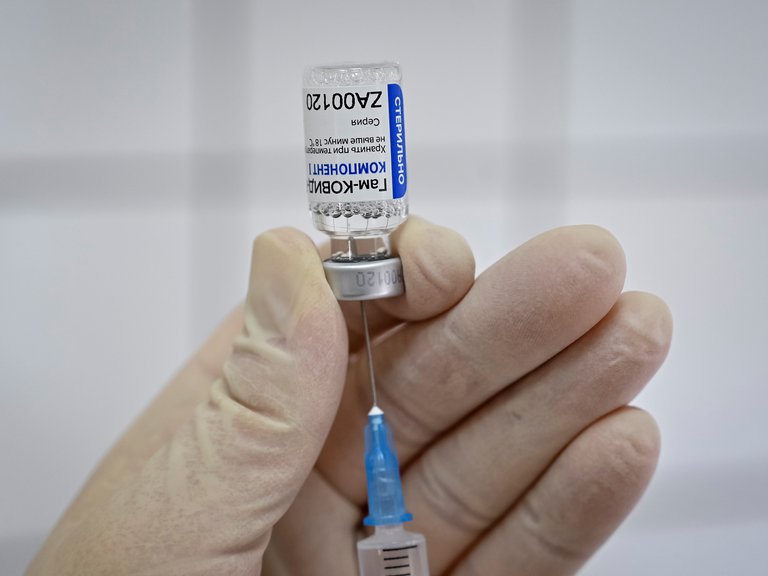
El Ministerio de Salud de la Nación autorizó con “carácter de emergencia” la vacuna rusa contra el COVID-19 Sputnik V,…
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (Anmat) autorizó en la noche del martes, de manera urgente y…
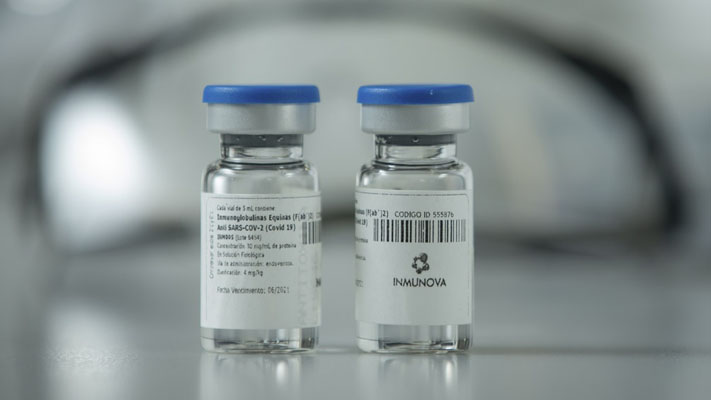
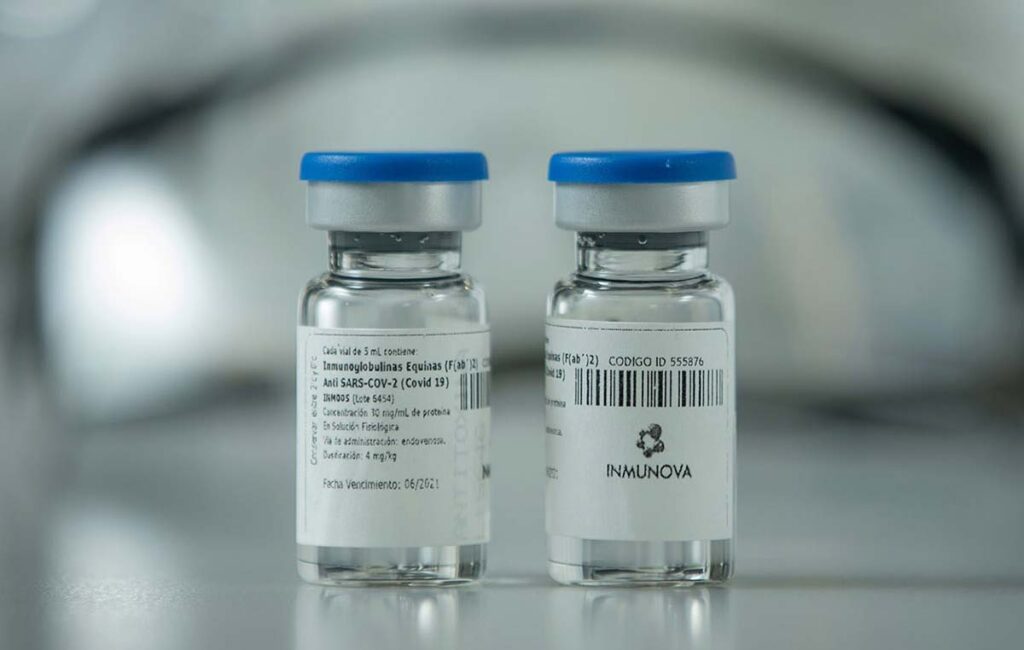
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (Anmat) aprobó el uso del suero equino hiperinmune para el tratamiento…
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (Anmat) prohibió este miércoles la comercialización en todo el territorio nacional…
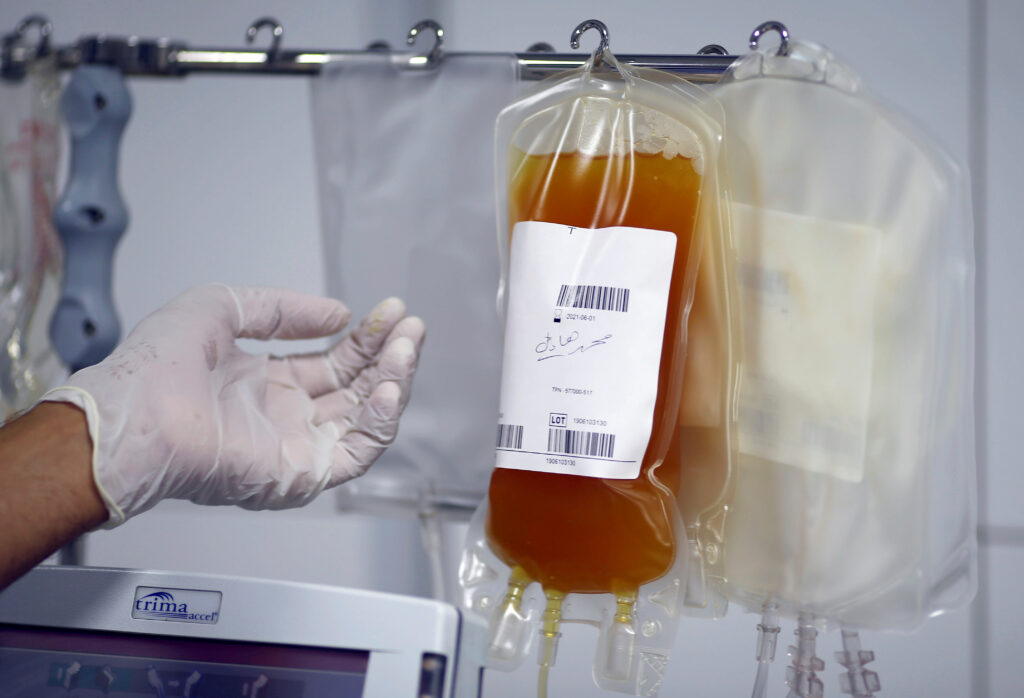
La semana pasada se dio a conocer que el plasma de convaleciente con altos títulos (cantidad) de anticuerpos aplicado antes…
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica ( ANMAT) prohibió el uso, la comercialización y distribución en todo…
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) prohibió la comercialización de una marca de miel en todo…
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (Anmat) aprobó la fabricación de un respirador mecánico diseñado y desarrollado…
El Neokit Covid-19 y Neokit Plus fueron desarrollados por científicos y científicas del Conicet del Instituto César Milstein, en el…
Por la disposición 6945/2020, publicada en el Boletín Oficial, la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) prohibió…
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) alertó, a través de la página oficial del Ministerio de…
Tras analizar la denuncia presentada por un particular, la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) descubrió la presencia de…
La ANMAT aprobó el protocolo de investigación del estudio clínico de Fase 2/3 para probar en pacientes la seguridad y…
Según informó este viernes la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (Anmat), la solución hiperinmune desarrollada a base…
La Administración Nacional de Medicamentos, Alimentos y Teconología Médica también sacó de circulación dos alfajores bañados en chocolate y dos…
Se trata de productos cuya marca comercial fue usurpada, por lo que no se garantiza la calidad del producto. La…
Un grupo de desarrolladores avanza en el diseño y la elaboración de respiradores de bajo costo, un insumo difícil de…
Con el objetivo de que el Poder Ejecutivo Nacional efectivice una prohibición que se encuentra vigente, el diputado nacional chubutense…
El supermercado emitió un comunicado para aclarar que el producto «no se encuentra a la venta en sus sucursales desde…
Por una denuncia de un consumidor al sospechar que el alimento podría contener leche. La Administración Nacional de Medicamentos, Alimentos…
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) prohibió la comercialización de una yerba mate por haber detectado…
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) prohibió este miércoles a través del Boletín Oficial varios alimentos…
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) prohibió la comercialización y distribución en todo el territorio nacional…
Se trata del producto Puré de pera Baby Natural, marca Finca Isis, «La Naturaleza Envasada». La Administración Nacional de Medicamentos,…
La medida es porque el producto no está inscripto en el Registro de Productores y Productos de Tecnología Médica. La…
El chocolate «habría generado una reacción alérgica en un menor de edad sensible a la leche, huevo y nuez». Tal…
El organismo de control retiró el producto de la marca Lester Free de manera preventiva, dado que no fue autorizada…
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) prohibió a través de la disposición 7894/2019 la comercialización en todo el…
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (Anmat) prohibió la comercialización de un edulcorante de la marca Jual Stevia ya que…
La Administración Nacional de Medicamentos Alimentos y Tecnología Médica (ANMAT) prohibió la comercialización del agua de mesa envasada y retornable…
Es un medicamento que se utiliza para «tratar el carcinoma de células renales», un tipo de cáncer de riñón. Según…
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (Anmat) prohibió un hummus vegano que causó la intoxicación de dos…
El Boletín Oficial publicó este martes la prohibición de la Anmat para sacar a la venta unas toallitas para bebés,…
Si bien aún está en etapa de evaluación en la ANMAT, esta novedad anunciada por científicos argentinos permitiría reducir las posibles…
La Administración Nacional de Medicamentos, Alimentos y Tecnología Medicamentos, Alimentos y Tecnología Médica (Anmat) prohibió la comercialización de dos productos…
La Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) prohibió la comercialización de una leche en polvo a través de la…